苏州和诺生物科技有限公司
Suzhou Heno Biotechnology Co.,Ltd
产品订购热线 (86)0512 - 62371883
快速查询您想要的产品
ELISA实验步骤:
1、试剂准备:根据选择的试剂盒准备好相关试剂。
2、样品准备:血清、血浆、尿液、胸腹水、脑脊液、细胞培养上清、组织标本等。
3、试剂的配置
4、抗体包被:Coating Buffer: 稀释成Coating Buffer (1×),根据产品说明书稀释抗体,每孔加入100ul预稀释的抗体,4°C过夜孵育(16-18h)。
5、使用前,将所有试剂充分混匀,避免产生泡沫。
6、根据实验孔(空白和标准品)数量,确定所需的板条数目。样品(含标准品)和空白都应做复孔。
7、加样:100 μL/well 加入稀释后的 Cytokine standard 至标准品孔,100 μL/well 加入样
品至样品孔,100 μL/well 加 Dilution buffer R (1×)入空白对照孔。
8、加检测抗体:根据产品说明书加入 Biotinylated antibody 。 混匀后盖上封板膜,室温孵育。
9、洗板:扣去孔内液体,300 μL/well 加入 1×washing buffer;停留 1 分钟后弃去孔内液体。重复 3 次,每一次在滤纸上扣干。
10、加酶:根据产品说明书加入稀释好的酶,孵育。
11、洗板:重复步骤 5 。
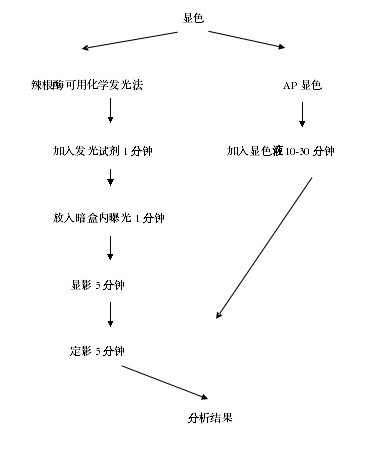
12、显色:100 μL/well 加入 TMB,室温(18-25℃)避光孵育5-30分钟之间,根据孔内颜色的深浅(深蓝色)来判定终止反应。 通常显色 10-20 分钟可以达到很好的效果。
13、终止反应:迅速 100 μL/well 加入 Stop solution 终止反应。
14、读板:终止后 10 分钟内,用检测波长(measurement wavelength)450 nm 读值。推荐用双波长即检测波长(measurement wavelength)450 nm 、参考波长或校正波长(reference wavelength )610-630 nm 同时读板,测量结果会更准确。
ELISPOT实验步骤:
第一天:ELISPOT包被程序,提供两种方案供选择(严格注意无菌操作)
方案A: 传统酒精预湿包被程序
该方案中,需经过:70%乙醇预湿PVDF膜、无菌去离子水洗涤去除乙醇、拍干,最后,加入已稀释好的包被抗体到各实验孔完成包被操作。
具体操作如下:
1. 实验卡片填写:设计好试验,把每个孔要加入的内容做成卡片,到时候就会从容很多。
2. 每孔加入15μL 70%的乙醇预湿。
注意:
未润湿PVDF膜是洁白、不透明的;经乙醇润湿后,颜色变暗,呈半透明状,很容易观察二者的区别。
加乙醇时,枪头应该靠在孔壁接近孔底的地方,注意枪头不要刺到PVDF膜。
若加入的乙醇挂在孔壁上,盖上板盖,轻轻叩击,让乙醇顺势滑落。乙醇一旦接触到PVDF膜,就会在表面张力和毛细作用之下迅速浸润整块膜,使得膜的颜色和透明度发生变化。
15μL是经过优化的体积,能保证刚好完全浸润整块膜,而不会有剩余。请勿随意加大用量!
膜在润湿后如果不做处理,大约10min后由于乙醇的挥发会重新变干。所以应该在膜变干之前加入去离子水,两步的时间间隔不要超过5min。否则,膜需要重新润湿。
3. 洗涤:100μL/孔加入去离子水,洗涤2次。
本次洗涤目的在于:除去预湿用的乙醇。因此应该尽量洗涤干净,减少残留。
4. 包被:按说明书操作。50μL/孔加入用1×PBS稀释好的包被抗体,4°C包被过夜。
5. 封闭:(次日)倾倒包被液,用无菌1×PBS洗涤3次。最后一次,在灭菌的吸水纸上扣干。200μL/孔加入稀释好的封闭液,37°C封闭1h。
6. 倾倒封闭液,无须洗涤,直接加入检测细胞进行ELISPOT检测。
方案B: Magi™ Coating Buffer润湿包被程序
该方案中,用Magi™ Coating Buffer润湿PVDF孔后,直接加入用1×PBS稀释的包被抗体,即可完成抗体的包被。
1. 实验卡片填写:设计好试验,把每个孔要加入的内容做成卡片,到时候就会从容很多。
2. 每孔加入15μLMagi™ Coating Buffer预湿。
注意:
未润湿PVDF膜是洁白、不透明的,经Magi™ Coating Buffer润湿后,颜色变亮,呈半透明状,很容易观察二者的区别。
加Magi™ Coating Buffer时,枪头应该靠在孔壁接近孔底的地方,注意枪头不要刺到PVDF膜。
若加入的Magi™ Coating Buffer挂在孔壁上,盖上板盖,轻轻叩击,让Magi™ Coating Buffer顺势滑落。Magi™ Coating Buffer一旦接触到PVDF膜,就会在表面张力和毛细作用之下迅速浸润整块膜,使得膜的颜色和透明度发生变化。
3. 包被:润湿之后,无须洗涤。每孔加入50μL PBS稀释好的包被抗体,4°C包被过夜。
4. 封闭:(次日)倾倒包被液,用PBS洗涤3次。最后一次,在灭菌的吸水纸上扣干。200μL/孔加入用1×PBS稀释好的封闭液,37°C封闭1h。
5. 倾倒封闭液,无须洗涤,直接加入检测细胞进行ELISPOT检测。
第二天:接种细胞,加入刺激物,培养(严格注意无菌操作)
整个实验设置1组正对照(PHA刺激),每一个细胞样品(同一个捐献者或实验动物)要设1组负对照(不加刺激物),整块板还要加1组背景负对照(不含细胞,只加培养基和所有检测试剂)。
1. 填好实验卡片,用以指导实验安排及细胞和试剂的添加。每一个细胞/刺激物的组合设复孔(建议2-4孔,客户可根据实验要求自行调整复孔数目)。
2. 取出封闭好的板,准备加入细胞。如果是以前做的封闭,先加入200μL的Lympho-Spot™无血清培养基室温静置10min,然后倾倒。
3. 细胞上板:按照实验卡片的安排,接种不同浓度的细胞,100μL/well,细胞在孔中的分布要尽量均匀(要诀是加入细胞之后,不要再震动或者拍击ELISPOT板。有人认为拍击板子会让细胞更分散,实际情况刚好相反)。
(1)正对照:细胞浓度为1×104 cells/well。
(2)细胞样品:样品细胞浓度请实验者自行摸索调整,通常为1~5×105cells/well。
(3)背景负对照:加入100μL的Lympho-Spot™无血清培养基,该孔即为背景负对照孔。
4. 刺激物:特异性刺激物和非特异性刺激物之分。
5. 正对照孔加入10μL PHA,终浓度1-4ug/mL,该浓度能有效刺激IFN-γ的分泌。
6. 加入实验者自己的刺激物(用Lympho-Spot™无血清培养基配制成10×终浓度,10μL/well)到实验孔。加完刺激物后不要再拍击ELISPOT板。有人认为拍击板子会让刺激物在孔中混合均匀。实际上,通过扩散,刺激物会很快混合均匀。拍击板子会让细胞聚集分布在孔的外周。
7. 加完所有的样品之后,盖上板盖,放入二氧化碳培养箱,37°C培养18-24h。
注意:
碰撞会引起细胞移位,造成斑点模糊、拖尾。在整个培养过程中应避免移动、碰撞培养板,并尽量减少开关培养箱的次数。
第三天:培养后操作(不再需要无菌操作)
1. 裂解细胞:倾倒孔内的细胞及培养基,200μL/孔加入冰冷的去离子水,4°C冰浴10min(低渗法裂解细胞)。
2. 洗涤:每孔加入200μLPBST,浸泡3-5mins后扣出洗涤液,重复5次。最后一次,在吸水纸上扣干。
3. 加入检测抗体:每孔加入100μL稀释好的生物素标记检测抗体,37°C孵育1h。
4. 洗涤:每孔加入200μLPBST,浸泡3-5mins后扣出洗涤液,重复5次。最后一次,在吸水纸上扣干。
注意:
有实验者认为,洗涤检测抗体和酶标亲和素时,膜的背面也需要清洗。经我们验证,不清洗膜的背面也完全可以得到满意的结果,但是如果清洗,背景会更干净一些。所以,清洗膜的背面为实验的优化步骤,是否略过,由实验者自行决定。
洗涤膜的背面,我们的方法是:在洗涤最后一次时,将去除塑料保护层的PVDF膜板底面浸入盛有干净PBST的浅托盘中,轻轻漂洗几次即可。
一定要将膜背面和塑料保护层上的液体甩干后,再合拢,盖上,不要划伤到膜。
5. 加入酶标亲和素:每孔加入100μL稀释好的酶标亲和素,37°C 1小时。
6. 洗涤:每孔加入200μLPBST,浸泡3-5mins后扣出洗涤液,重复5次。最后一次,在吸水纸上扣干。
7. 显色:解冻已配好的AEC显色液。每孔加入100μL的显色液,室温静置15-45min(在20 -25°C,显色25min较合适),注意避光。
8. 待斑点生长到适合的大小之后,以去离子水洗涤2遍,终止显色过程。将板倒扣在吸水纸上,拍干细小的水珠,之后取下保护层,放在通风的地方,室温静置10-30min,让膜自然晾干。注意不要将板放到烤箱内,防止膜发脆、破裂。
9. 将ELISPOT板置于Biosys Bioreader自动读板仪内,调节好合适的参数,斑点计数,并记录斑点的各种参数,做统计分析。
IHC实验步骤:
标本:组织标本:石蜡切片(病理切片和组织芯片)、冰冻切片;细胞标本:组织印片、细胞爬片、细胞涂片
操作步骤:
①石蜡切片制作
1、固定:取组织,用PBS冲洗,放入4%多聚甲醛磷酸盐缓冲液内固定12h
2、脱水:倒去固定液,用蒸馏水冲洗3次,再用50%酒精冲洗2次,用酒精逐级脱水,70%酒精1天,80%酒精过夜,95%酒精3h,无水酒精(Ⅰ)、(Ⅱ)各2h
3、透明:1:1无水酒精二甲苯45min,二甲苯(Ⅰ)、(Ⅱ)各30min
4、包埋:(恒温箱内进行)浸入石蜡,1:1二甲苯石蜡(58℃)45min,石蜡(Ⅰ)、(Ⅱ)、(Ⅲ)共2.5h,用石蜡(Ⅲ)包埋组织
5、切片:包埋后的组织块经修整后,用切片机切成5-7μm,的石蜡带
6、贴片:将组织石蜡块在50℃温水中展片,然后用处理干净的载玻片捞片,组织带可黏在载玻片上
(洗片:1%HCl浸泡过夜、蒸馏水冲洗、95%酒精浸泡2h后擦干 → 涂胶:防脱剂多聚赖氨酸)
7、烤片:68℃恒温箱内烤片2h
②SP三步法
1、脱蜡:脱蜡前应将组织芯片在室温中放置60min,或60℃恒温箱中烘烤20min,后用二甲苯(Ⅰ)、(Ⅱ)浸泡,共25min
2、水化:无水酒精(Ⅰ)、(Ⅱ)各2min,下行至95%、80%、70%酒精(Ⅰ)(Ⅱ)各2min
3、PBS冲洗2-3次,每次5min
4、阻断:3%H2O2去离子水(或80%甲醇)孵育10min,以灭活内源性过氧化物酶活性
5、PBS冲洗2-3次,每次5min
6、抗原修复:置0.01M枸橼酸缓冲液(PH 6.0)中用煮沸(95℃,15-20min),自然冷却20min以上,再用冷水冲洗缸子,加快冷却至室温
7、PBS冲洗2-3次,每次5min
8、封闭:滴加正常山羊血清封闭液,室温孵育20min,甩去多余液体
9、滴加Ⅰ抗50μl,室温静置1h,或者37℃1h,或者4℃过夜(需在37℃复温45min)
10、PBS冲洗2-3次,每次5min
11、滴加辣根过氧化物酶标记的Ⅱ抗40~50μl,室温静置1h,或37℃1h
12、PBS冲洗2-3次,每次5min
13、滴加SP(链霉亲和素-过氧化物酶),室温或37℃孵育30min-1h
14、PBS冲洗2-3次,每次5min
15、显色:DAB显色5-10min,在显微镜下掌握染色程度(胞浆呈棕色者判定为阳性细胞)
(显色剂的配置:在1ml水中加1滴显色剂A,摇匀,然后加1滴显色剂B,摇匀,再加1滴显色剂C,摇匀)
(A:DAB B:H2O2 C:磷酸缓冲液)
16、自来水冲洗10分钟终止反应
17、复染:苏木精复染2min,盐酸酒精分化
18、自来水冲洗10-15min
19、常规脱水、透明、封片(用中性树胶滴在组织旁边,再用盖玻片盖上)、镜检
③结果分析:每张切片选择5个高倍镜视野(400X),应用图像分析系统进行定量灰度扫描后进行分析。
WB实验步骤:
1、蛋白样品的制备:通过有机溶剂或水溶法制备总蛋白
2、做胶:检测抗原10-30kd, 用15%分离胶;30-100kd, 用10%分离胶;100-200kd,用7.5%分离胶。
3、跑胶:压缩胶电压:80V(10mA);分离胶电压:120V(20mA)当溴酚兰指示剂到达凝胶底部时,即停止电泳。
4、转膜:目的蛋白分子80-140kDa时,胶浓度8%,转移时间为1.5-2小时;目的蛋白分子25-80kDa时,胶浓度10%,转移时间为1.5小时;目的蛋白分子15-40kDa时,胶浓度12%,转移时间为0.75小时;目的蛋白分子<20kDa时,胶浓度15%,转移时间为0.5小时;
5、封闭:脱脂奶粉(5%)、BSA、Western Blot 膜封闭液
6、一抗杂交:5%奶粉或2%BSA稀释抗体(称一抗),稀释比例按抗体说明,室温孵育1hr,TBST 洗5 mins 3-5 次。
7、二抗杂交:将膜跟5%奶粉或2%BSA稀释的2 抗一起孵育,室温1hr。TBST 洗5 mins 3-5 次。
8、底物显色:
流式实验步骤:
一、流式胞内细胞因子染色步骤
固定:
1. 在进行胞内染色之前(如:IFN-r或者IL-4),可根据BioLegend 细胞表面荧光染色步骤染表面标记,然后用Fixation Buffer (Cat:420801)固定细胞,每管0.5m l固定液,室温避光孵育固定20min。
2. 350g,离心,5 minutes,弃上清。
3. 如果有中止实验的需要,可在此步暂停,保存细胞一段时间,以备将来继续操作实验。用Cell Staining Buffer洗一遍细胞,350g,离心,5 minutes,弃上清。Cell Staining Buffer重悬细胞,可在4°C短期保存。或者用90% FCS/10% DMSO 在-80度较长期保存(注:针对固定后且无表面染色标记的细胞长期保存)。活化的人PBMC 的细胞因子的表达量会因供者的不同有所变化。因此 如果想纵向比较,冻存过的细胞来源于同一个供者较好。
破膜:
4. 稀释10X的Permeabilization Wash Buffer (Cat. No. 421002)成1X的工作液
5. 用Permeabilization Wash Buffer重悬固定的细胞,350 g 离心 5-10 minutes,弃上清。
6. 2次重复步骤5。
胞内染色:
7. 100ul Permeabilization Wash Buffer 重悬固定破膜后的细胞,加入特定的荧光标记抗体(抗体量根据说明书加),室温避光20min。
8. 用 2 ml Permeabilization Wash Buffer 把细胞洗两遍。350 g离心 5 minutes,弃上清。
9. 如果一抗是生物素标记的,接下来就要加链霉亲和素偶联的二抗。再用Permeabilization Wash Buffer 洗2遍,350 g离心 5 minutes。
10. 用0.5 ml Cell Staining Buffer 重悬固定染色后的细胞,上机检测分析。
全血标本活化和胞内染色步骤:
1. 用无菌的组织培养液 1:1 稀释肝素抗凝的全血。
2. 可用抗原或者丝裂原体外刺激细胞。如果打算做胞内抗原如IFN-γ 或IL-4 ,添加蛋白转运抑制剂很关键,如brefeldin A (Cat. No.420601) 或者 monensin (Cat. No. 420701)。在添加适量的胞内刺激剂后,把全血分装到12 x75 mm的塑料培养管中,每管200ul,5% CO2 ,37°C,孵箱孵育4-6小时。
3. 加入2ml红细胞裂解液(Cat: 420301),室温孵育5-10min。
4. 350 g 离心 5 minutes,弃上清。
5. 用Cell Staining Buffer再把细胞洗一遍,然后进行表面荧光染色。
6. 固定细胞,破膜,根据上面所描述的进行胞内抗原染色。
二、细胞表面抗原流式染色步骤
组织或细胞收集:
1.获取实验的组织(脾脏、淋巴结、胸腺、骨髓),然后制备单细胞溶液,buffer用的是细胞染色液cell staining buffer(BioLegend Cat#420201)。如果是体外刺激培养的细胞,可简单的用cell staining buffer重悬已刺激的细胞,再进行步骤2。
2.添加细胞染色液到分离管至15ml,然后350g离心,5 min,弃上清。
红细胞裂解:
3.如果做的组织是脾脏,需要裂解红细胞。首先把10X的红细胞裂解液10X Red Blood Cell (RBC) Lysis Buffer (BioLegend Cat#420301)用去离子水配制成1X工作液。向管中加入3ml红细胞裂解液重悬细胞,冰上孵育5min。
4.向管中加入10ml 细胞染色液以终止裂解作用。然后350g离心,5 min,弃上清。
5.重复步骤2洗细胞一遍。
6.活细胞计数后,加细胞染色液调整细胞数浓度在5-10 x 10^6cells/ml,以每管100ul的细胞液分装到流式管中,这样细胞数浓度接近于5-10 x 10^5cells/ml
FC受体阻断:
7.FC受体的阻断试剂可以有效的减少非特性的荧光染色。对小鼠标本,用anti-mouse CD16/CD32纯化抗体(针对Fcγ R III/II,BioLegend cat#101302, clone 93),能阻断非特异的受体。加入5-10ug/ml的 anti-mouse CD16/CD32,冰上预孵育细胞10min,就可以了。由于没有用于人和大鼠的阻断FC的抗体,一个可选的方案就是用过量的不相关的纯Ig预孵育阻断。
细胞表面染色抗体:
8.加入适量的有荧光标记的、生物素化或者纯化的一抗(如: anti-CD3-FITC、anti-CD4-Biotin、anti-CD8-APC)到已准备好的细胞悬液里。 冰上暗处孵育15-20min。
9.加入至少2ml的细胞染色液洗2次,350g离心,5 min,弃上清。
10.如果先前加入的是纯化的一抗,则用管中残留的buffer 重悬细胞,再加入针对特定免疫球蛋白的荧光标记的二抗。二抗需是预先滴定到最佳浓度,且是抗一抗抗体种属来源并联有荧光的免疫球蛋白。例如:FITC-anti-mouse Ig。加入后冰上避光孵育15-20min。
如果先前加入的是生物素标记的一抗,则用管中残留的buffer 重悬细胞,再加入荧光SAv试剂。需是预先滴定到最佳浓度,连接有荧光素的SAv试剂。比如:SAv-PE.(BioLegend Cat# 405204)。加入后冰上避光孵育15-20min。
11.重复步骤 9.
12.加入0.5ml的Cell Staining Buffer重悬细胞,再加入5ul(含0.25ug/ million cells)的7-AAD活性染色剂(BioLegend cat#420403) 来排除死细胞。注意:BioLegend不建议使用7-AAD时合用PE/Cy5、 PerCP、或 PerCP/Cy5.5等染料。
13.冰上暗处孵育3-5min。
14.流式细胞仪分析。
全血标本的流式染色方案:
1.每管准备100ul 抗凝全,再加入预先滴定到最佳浓度的链有荧光素、生物素或者是纯化的一抗。
2.室温避光孵育15-20min。
3.把10X的红细胞裂解液(BioLegend Cat #420301)用去离子水配制成1X工作液,使用前室温平衡。每管(100ul全血,已孵育抗体)加2ml 的1X的红细胞裂解液,混匀,室温避光孵育10min。
4.350g离心,5 min,弃上清。
5.用至少2ml的Cell Staining Buffer洗一遍,350g离心,5 min,弃上清。
6,如果先前加入的是纯化的一抗,则用管中残留的buffer 重悬细胞,再加入针对特定免疫球蛋白的荧光标记的二抗。二抗需是预先滴定到最佳浓度,抗一抗种属并联有荧光的免疫球蛋白。比如说:FITC-anti-mouse Ig,加入后冰上避光孵育15-20min。
如果先前加入的是连有生物素的一抗,则用管中残留的buffer重悬细胞,再加入荧光SAv试剂。需是预先滴定到最佳浓度,连接有荧光素的SAv试剂。比如:SAv-PE.。加入后冰上避光孵育15-20min。
7.重复步骤5。
8.加入0.5ml的Cell Staining Buffer重悬细胞或者0.5ml含2%多聚甲醛的PBS固定液。
9.上流式分析。